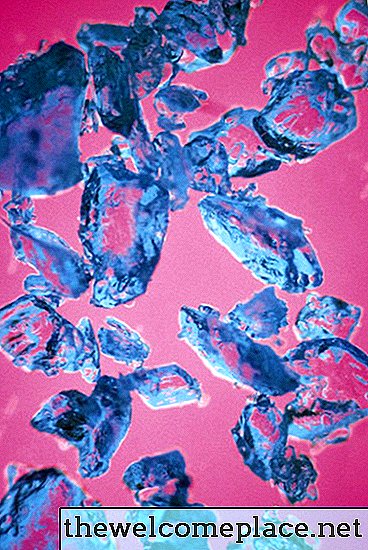
कई संक्रमण धातु परिसरों की तरह, तांबा (II) सल्फेट पेंटाहाइड्रेट चमकीले रंग का है; इस सुंदर पदार्थ के क्रिस्टल नीले रंग की एक पीला छाया हैं। इसका रंग इसकी संरचना के रसायन विज्ञान और भौतिकी से उपजा है - या, और अधिक विशेष रूप से, यह जिस तरह के बॉन्ड से सल्फेट आयनों और तांबे से जुड़े पानी के अणुओं के साथ बनता है।
 कॉपर सल्फेट पेंटाहाइड्रेट में एक सुंदर पारभासी नीला रंग होता है।
कॉपर सल्फेट पेंटाहाइड्रेट में एक सुंदर पारभासी नीला रंग होता है।कक्षाओं
इलेक्ट्रॉन तरंग-कण द्वैत का प्रदर्शन करते हैं, जिसका अर्थ है कि उनके पास तरंग-जैसे गुण और कण-जैसे गुण हैं। एक परमाणु में एक इलेक्ट्रॉन का व्यवहार एक तरंग-जैसे समीकरण द्वारा वर्णित किया जाता है जिसे तरंग कहा जाता है। वेवफंक्शन का वर्ग संभावना देता है कि इलेक्ट्रॉन किसी भी एक विशेष बिंदु पर किसी भी समय पाया जाएगा। परमाणुओं में इलेक्ट्रॉनों की तरंगों को परमाणु ऑर्बिटल्स भी कहा जाता है। केमिस्टों ने कक्षीय के प्रकार को नामित करने के लिए एक पत्र के बाद कक्षीय के ऊर्जा स्तर को नामित करने के लिए एक संख्या का उपयोग करके परमाणु कक्षाओं का नाम दिया। आवर्त सारणी की चौथी अवधि या उससे ऊपर के तत्वों के लिए, आपको केवल तीन प्रकार के ऑर्बिटल्स पर ध्यान देने की आवश्यकता है, अर्थात्, एस, पी और डी। इन ऑर्बिटल्स के आकार के लिए एक महसूस करने के लिए, संसाधन अनुभाग में लिंक देखें।
क्रिस्टल क्षेत्र विभाजन
कॉपर (II) सल्फेट में कॉपर आयन ने दो इलेक्ट्रॉनों को खो दिया है, इसलिए इसमें +2 चार्ज है। इसके सबसे बाहरी ऊर्जा स्तर या शेल में नौ इलेक्ट्रॉन हैं; ये तथाकथित वैलेंस इलेक्ट्रॉनों सभी 3 डी ऑर्बिटल्स पर कब्जा कर लेते हैं। पानी के अणु और सल्फेट आयन कॉपर आयन पर सकारात्मक चार्ज के लिए आकर्षित होते हैं, इसलिए वे इसे दृष्टिकोण करते हैं और एक अष्टकोणीय विन्यास में इसके चारों ओर व्यवस्था करते हैं। नतीजतन, कॉपर आयन के पांच डी ऑर्बिटल्स में से दो कुल्हाड़ियों के साथ संरेखित होते हैं जिसके द्वारा सल्फेट आयन और पानी के अणु दृष्टिकोण करते हैं; चूँकि इन ऑर्बिटल्स में इलेक्ट्रॉनों और अणुओं / आयनों में इलेक्ट्रॉनों का ऋणात्मक आवेश होता है, इसलिए वे एक दूसरे को प्रतिकर्षित करते हैं। अंततः, फिर, पांच में से दो 3 डी कक्षाओं ने ऊर्जा में वृद्धि की है; इन्हें जैसे ऑर्बिटल्स कहा जाता है। अन्य तीन, इसके विपरीत, ऊर्जा में कमी आई है और इसे टी 2 जी ऑर्बिटल्स कहा जाता है।
प्रकाश का अवशोषण
प्रकाश का एक फोटॉन समन्वय परिसर द्वारा अवशोषित किया जाएगा यदि इसमें एक इलेक्ट्रॉन राज्य में अंतर के बराबर ऊर्जा होती है जो अब विद्यमान है और इसके लिए उपलब्ध दूसरे राज्य की ऊर्जा। नतीजतन, कॉपर सल्फेट कॉम्प्लेक्स t2g और उदाहरण के ऑर्बिटल्स के बीच ऊर्जा के अंतर के बराबर ऊर्जा के साथ प्रकाश के फोटोन को अवशोषित कर सकता है। जैसा कि होता है, कॉपर सल्फेट कॉम्प्लेक्स के लिए ऊर्जा का अंतर स्पेक्ट्रम के लाल-नारंगी क्षेत्र में प्रकाश के फोटॉनों के लिए ऊर्जा के अंतर के बराबर होता है। चूंकि नीली रोशनी फैलने पर लाल रंग का प्रकाश अवशोषित होता है, इसलिए कॉपर सल्फेट नीला दिखाई देता है।
जल में घुलना
जब कॉपर सल्फेट पानी में घुल जाता है, तो कॉपर और सल्फेट आयन अलग हो जाते हैं। अब तांबा आयन एक अष्टकोणीय परिसर बनाता है जहां यह पानी के छह अणुओं से घिरा हुआ है। प्रभाव अभी भी बहुत अधिक है, हालांकि, क्योंकि इस नए परिसर में t2g ऑर्बिटल्स और उदाहरण के ऑर्बिटल्स के बीच विभाजन अभी भी ऐसा है कि लाल-नारंगी प्रकाश अवशोषित हो जाता है और आपको एक नीले रंग का समाधान दिखाई देता है।